引言:从vein-to-vein到off-the-shelf,in vivo CAR-T时代到来
自2017年全球首款 CAR-T 产品 Kymriah 获批以来,细胞疗法彻底改写了血液肿瘤的治疗格局,同时人们也寄希望于 CAR-T 技术能在未来彻底解决肿瘤问题。然而,这种“活的药物”在生产、定价等各个环节也带来了前所未有的挑战:从质粒到病毒到细胞的复杂的生产工艺,长达数周的 “vein-to-vein” 时间,个性化的细胞制备,共同构筑了细胞治疗产品的高昂的生产成本以及百万人民币和动辄数十万美元的售价,使得 CAR-T 细胞产品的应用始终没能全面打开为更多的患者提供最前沿有效的治疗技术。正是在这样的背景下,in vivo CAR-T(体内CAR-T)技术应运而生,它描绘了一幅颠覆性的图景:将复杂的细胞工程实验室“微缩”并直接注入患者体内,实现T细胞的原位改造,使得原来体外的所有生产制备环节在患者体内完成,这不仅意味着治疗流程的极大简化,更预示着一种真正“货架可及”(off-the-shelf)的新的体内细胞疗法时代的到来。
更让人振奋的是,in vivo CAR-T 补齐了传统 ex vivo CAR-T 的技术短板。它能在致密的肿瘤微环境动态发挥作用,且避免了淋巴耗竭预处理风险。这使其在实体瘤与自身免疫疾病这两大未被满足的临床需求上展现出的巨大潜力。从2024年到2025年,全球制药巨头(Big Pharma)纷纷通过巨额投资与并购,以前所未有的力度布局这一前沿领域,一场围绕下一代细胞疗法的“军备竞赛”已然打响:
2024年1月:Umoja Biopharma完成C轮融资
Umoja Biopharma宣布完成1亿美元的C轮融资,以推进其独特的 in vivo CAR-T平台。该公司采用基于慢病毒载体的VivoVec技术,旨在实现体内T细胞的精准改造,其资产UB-VV400已进入临床阶段。
2024年2月16日:Astellas与Kelonia达成合作
Astellas(通过其子公司Xyphos Biosciences)与Kelonia Therapeutics达成一项价值高达8亿美元的研究合作与许可协议。双方旨在结合Kelonia的iGPS™(in vivo Gene Placement System)技术与Xyphos的ACCEL™技术,共同开发用于多种癌症的in vivo CAR-T疗法。
2024年11月20日:Novartis联手Vyriad
CAR-T领域的先驱Novartis与Vyriad, Inc.达成战略合作,共同开发基于慢病毒载体平台的in vivo CAR-T疗法。尽管具体合作金额未披露,但此举标志着Novartis在巩固其CAR-T领导地位的同时,积极向下一代“现货型”技术拓展。
2025年3月17日:阿斯利康收购EsoBiotec
阿斯利康(AstraZeneca)宣布以10亿美元收购比利时私营公司EsoBiotec,获得其专有的ENaBL™平台。该平台采用第三代免疫屏蔽慢病毒载体技术,用于开发in vivo CAR-T疗法,其首个靶向BCMA的候选药物ESO-T01已进入针对多发性骨髓瘤的临床试验。
2025年5月13日:Stylus Medicine获明星资本加持
Stylus Medicine宣布完成8500万美元的A轮融资,投资方包括礼来(Eli Lilly)、强生(Johnson &; Johnson)和中外制药(Chugai)等行业巨头。该公司致力于利用其基因组工程和染色质调控技术,开发新一代的in vivo CAR-T疗法。
2025年6月30日:AbbVie重金押注LNP路线
AbbVie宣布以高达21亿美元的价格收购Capstan Therapeutics。此次交易的核心是Capstan的靶向脂质纳米颗粒(tLNP)技术平台及其领先的anti-CD19 CAR-T候选疗法,这笔交易被视为行业对LNP技术路线在in vivo CAR-T领域潜力的重磅认可。
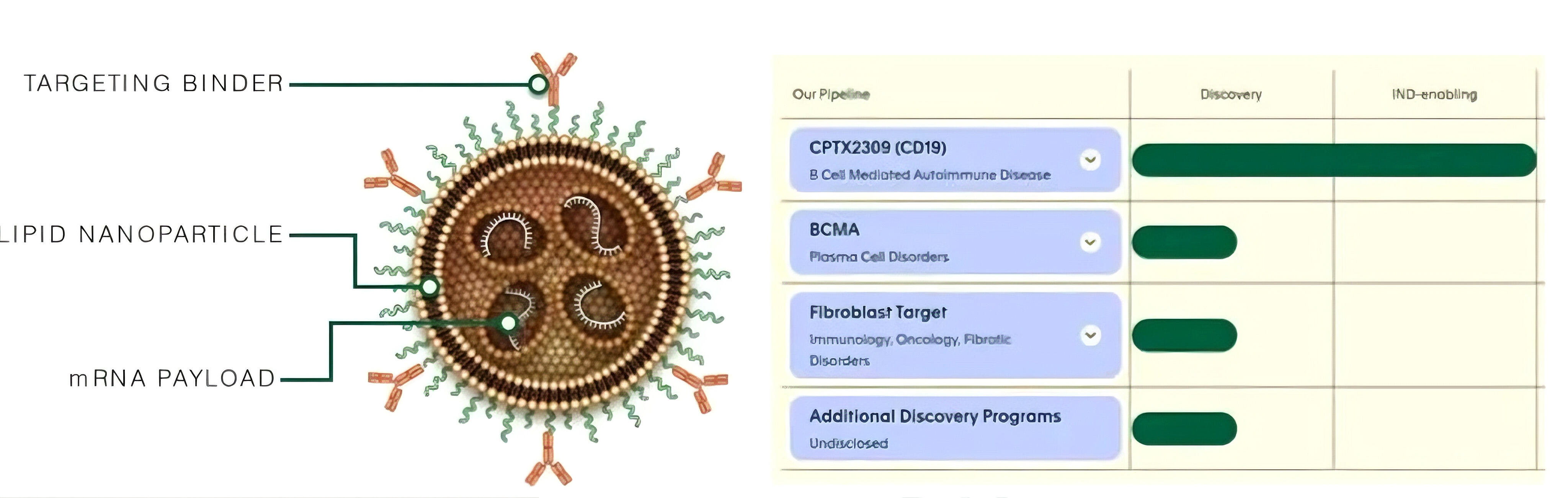
2025年8月21日:吉利德(Kite)收购Interius
吉利德科学(Gilead Sciences)旗下的细胞疗法子公司Kite宣布以3.5亿美元收购Interius BioTherapeutics。Interius专注于开发创新的in vivoCAR-T平台,此次收购进一步加强了Kite在细胞治疗领域的领导地位,并标志着其正式进军in vivo赛道。
这些动辄数亿的资本动作,不仅是对 in vivo CAR-T 临床价值的认可,更预示着其从实验室走向产业化的关键转折点已然到来。
递送路线之争:闪电战 VS 持久战
当前,in vivo CAR-T的核心在于如何高效、安全地将CAR基因递送至体内的T细胞。主流策略主要分为两大阵营:以脂质纳米颗粒(LNP)为载体的非病毒路径,和以慢病毒(Lentivirus)为代表的病毒载体路径。
要实现体内T细胞的精准改造,递送载体是整个技术的命脉。目前,行业使用的技术路线可分为五种,包括:
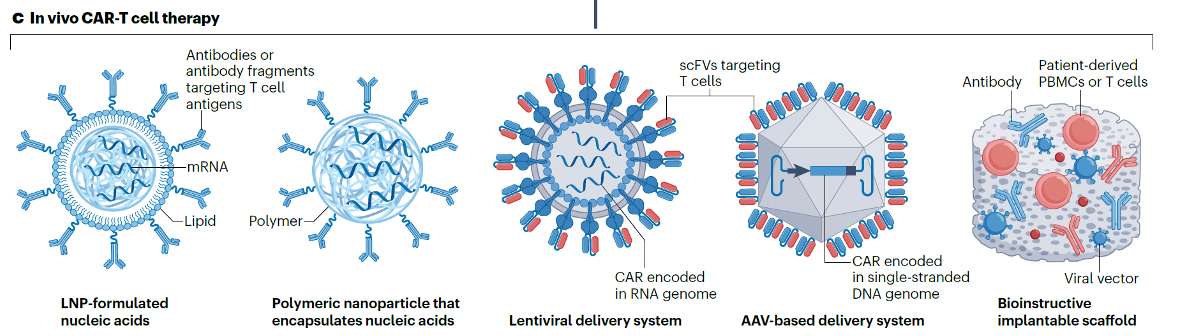
对于各个技术路线的详细探讨大家可以参考原文:Yan-Ruide Li,et al.In vivo CAR engineering for immunotherapy,nature reviews immunology.
目前行业的主要焦点集中在两大技术路线上:LNP和慢病毒载体(Lentiviral Vector, LV)。对这两条路线的深入分析,是理解in vivo CAR-T未来走向的关键。尽管没有一篇文献中的表格能完美囊括所有维度的对比,但综合多篇前沿综述,我们可以勾勒出两种技术路线的核心差异:
LNP-mRNA 路线:
- 优势: 生产相对快速、非病毒整合(理论上无插入突变风险)、免疫原性可能较低。
- 劣势: 表达瞬时,可能需要重复给药;转导效率相对较低;在体内环境中靶向T细胞的特异性和效率仍是重大挑战。
慢病毒载体 (LV) 路线:
- 优势: 稳定整合基因组,实现CAR的持久表达,为长期疗效提供基础;转导效率高,技术平台相对成熟。
- 劣势: 存在潜在的插入突变风险(尽管在ex vivo疗法中已通过质控手段有效管理);生产工艺相对复杂;可能引发针对病毒载体的免疫反应。
可以说,如果说LNP-mRNA是一场旨在快速控制战局的闪电战,那么慢病毒载体则是一场着眼于长治久安的持久战。两者没有绝对的优劣,只有场景适配的博弈,而这场博弈的胜负,正藏在不同疾病治疗的核心需求里:
肿瘤治疗:持久为王,但安全不能让步
无论是白血病这类液体瘤,还是胰腺癌这类实体瘤,“清除肿瘤 + 防止复发” 都是核心目标,但不同场景下,对 “持久” 与 “安全” 的权重取舍截然不同。
LNP-mRNA 优点:
- 安全性高:特别适合靶点有“on-target, off-tumor”(靶点在正常组织也有低表达)毒性的情况。由于CAR表达是瞬时的,即使出现严重的细胞因子释放综合征(CRS)或神经毒性,毒性也是可逆和可控的。
- 快速部署:可用于侵袭性极强的肿瘤,需要立即控制病情时。
- 可重复给药:可以根据病情需要,进行多个疗程的治疗,以维持或重新激活抗肿瘤效应。
LNP-mRNA 缺点:
- 持久性不足:CAR-T细胞的持续存在是清除肿瘤和防止复发的关键。mRNA的瞬时特性可能导致抗肿瘤效果不持久,肿瘤容易复发。
- T细胞记忆无法形成:难以形成记忆性CAR-T细胞,导致缺乏长期的免疫监视。
慢病毒载体优点:
- 持久性强:能建立长期、甚至终身的CAR-T细胞群体,提供持续的肿瘤杀伤和防止复发,这是当前体外CAR-T疗法成功的基础。
- 可形成记忆细胞:改造后的T细胞可以分化成记忆性T细胞,提供长期的免疫保护。
慢病毒载体缺点:
- 安全性风险:整合突变风险虽然在改进后已降低,但理论上始终存在。一旦发生严重CRS,无法通过停止CAR表达来快速缓解。
- 制造和成本:体内生产慢病毒载体的成本和质量控制是一大挑战。
结论:对于肿瘤治疗,慢病毒载体在持久性方面的优势目前看来更为关键。但LNP-mRNA在安全性要求极高的场景(如实体瘤,靶点毒性大)中是一个非常重要的补充和探索方向。
从上文提到的7笔交易中,除了Stylus和Captan外,其余均采用了慢病毒载体的技术路线,特别是最近的在细胞治疗领域最早获得成功的吉利德科学旗下的细胞疗法子公司Kite的选择,更加推高了行业对in vivo慢病毒载体技术路线的认可。
自身免疫病:可控比永久更重要
治疗红斑狼疮、多发性硬化症这类自身免疫病,核心逻辑不是清除,而是调节。既要压制过度活跃的免疫系统,又不能把正常免疫功能一棍子打死,更不能留下长期隐患。这时候,LNP 和慢病毒的差距,就成了适配与不适配的区别。
LNP-mRNA 优点:
-
- 可调控性:自身免疫疾病可能需要间歇性或可调节的治疗。LNP允许按需给药(例如在疾病活动期给药),在缓解期停止,模拟“药物”的给药模式,而非永久性改变免疫系统。
- 安全性:避免了对基因组永久修改所带来的长期不确定性,对于需要长期治疗的年轻患者尤为重要。
LNP-mRNA 缺点:可能需要频繁给药以维持疗效,影响患者生活质量。
慢病毒载体优点:
-
- “一劳永逸”:一次治疗,可能实现长期的疾病缓解甚至治愈,极大提高患者依从性。
- 持续调节:能够持续表达CAR(例如靶向自身反应性B细胞的CAAR),提供不间断的免疫抑制。
慢病毒载体缺点:
-
- 过度抑制风险:永久存在的抑制性CAR-T细胞可能导致广泛的免疫抑制,增加感染和肿瘤风险。
- 不可逆性:如果治疗策略需要调整(如出现新靶点或不良反应),无法撤回已改造的细胞。
结论:对于自身免疫病,LNP-mRNA的可调控性和安全性优势可能更大。将治疗作为一种“可控药物”而非“永久性细胞改造”更具吸引力。
看不见的战场:In Vivo CAR-T的真正瓶颈----CMC
In vivo CAR-T将治疗的复杂性从医院端前移到了药品生产端。无论选择哪种递送载体,其CMC的成熟度、可扩展性和成本,都将直接决定该技术能否真正从实验室走向广阔市场。
LNP-mRNA面临的工业化挑战与技术突破
LNP 的制备需精确控制脂质自组装过程。实验室采用的主流方法是微流控法。实验室级微流控芯片能精准控制LNP与 mRNA 混合,实现 90% 以上的包封率。然而,当放大至 GMP 生产时,设备物理尺寸大大限制流速(单通道每小时仅能处理数升溶液),且芯片易因脂质沉淀堵塞,导致批次间产量波动超 30%。辉瑞研究还发现,大规模混合过程中空气夹带会导致 LNP 结构重排,使 mRNA 包封率下降 30% 以上。
传统的乙醇注入法虽适合工业化,是CDMO企业的主流选择。但混合速率、pH 值、脂质比例等参数的微小波动会导致粒径分布拓宽,包封率骤降20%以上。后续的稀释、超滤步骤更增加工艺复杂性,每多一步操作就多 3% 的活性损失风险。
LNP脆弱的脂质双层结构更是提高了规模化生产的难度。在抗体偶联等靶向修饰场景中,需精确控制抗体密度(过高引发吞噬,过低影响靶向)。但在量产时,偶联效率批次差异常超 15%,导致 LNP 的结构被剪切力破坏,影响精准递送。
蓬勃生物目前通过搭建“表面偶联法+后插入法”的通用可放大平台,可以突破 LNP 规模化生产的偶联工艺核心难题,为 LNP 载体 CAR-T 的商业化提供了关键技术基础。但仍需在临床验证、长期稳定性、成本控制和CAR-T 特异性优化上进一步发力,才能完全支撑体内 CAR-T 从临床向商业化的落地。
慢病毒载体的规模化生产的工艺难点与技术突破
慢病毒载体(LVV)的规模化生产质量,其目前面临纯度、一致性与规模三大核心瓶颈。
- 高纯度要求:由于LVV需直接注射进入人体循环系统,其纯度必须达到“体内安全级”。生产中残留的杂质(如未消化质粒、宿主细胞蛋白、细胞碎片以及缺陷病毒颗粒)难以通过纯化完全去除。这些杂质不仅可能引起非特异性免疫反应,还可能导致脱靶效应或载体功能异常,严重威胁治疗安全性。
- 严格的批次一致性需求:In vivo给药要求LVV在不同批次间具备高度一致的病毒滴度、转导效率和靶向能力。传统瞬转工艺由于质粒转染效率的随机性和表达时间的不稳定性,导致关键质量属性(CQAs)波动显著,直接影响疗效的可预测性与监管合规性。
- 大规模生产的可行性挑战:In vivo CAR-T面向更广泛的患者群体,要求LVV生产实现工业级放大。然而,瞬转工艺在规模放大过程中常面临病毒功能性滴度下降、生产成本急剧上升等问题。例如,从10L反应器放大至100L时,有效滴度下降可达45%以上,难以稳定供应临床及商业化需求。
目前主流的多质粒瞬时转染技术因其“非整合、临时性”的本质,在应对上述挑战时存在不可逾越的障碍。
- 纯度方面:转染后大量残留质粒、转染试剂及细胞降解产物与病毒颗粒物理性质相近,使得下游纯化难以彻底分离;
- 一致性方面:质粒的摄取和表达水平受细胞状态和操作参数影响显著,导致不同生产批次间质量属性差异显著;
- 规模放大方面:瞬转不仅依赖大量GMP级质粒,其产率与可扩展性也远低于工业化要求,无法支撑未来商业化应用。
为从根本上解决LVV生产的瓶颈,深研生物正积极探索稳定细胞系构建技术。该策略通过将病毒元件稳定整合至宿主细胞基因组,实现可控、高效的病毒颗粒生产。
- 稳定整合与诱导表达完成纯度要求:利用转座子系统或同源重组技术,将 gag/pol、rev、包膜蛋白及靶向分子等元件稳定整合至细胞基因组中,并采用诱导型启动子实现“先扩增、后生产”的分离控制,显著提高完整病毒颗粒的比例,降低缺陷颗粒生成。
- 高性能克隆筛选与建库满足一致性要求:通过高通量自动化平台(如深研生物的EuBioX系统)对数千个候选克隆进行筛选,评估其单克隆性、病毒滴度、转导效率等指标,最终建立主细胞库(MCB),从而保证生产源头的一致性和标准化。
- 工艺兼容性与规模化潜力:稳定细胞系在贴壁或悬浮培养中均可实现高密度生长,且产量较瞬转提升显著(部分数据显示提高达20倍)。其与下游纯化工艺兼容性良好,易于放大至cGMP级别,满足从临床研究到商业供应的大规模生产需求。
(这部分内容摘自:https://mp.weixin.qq.com/s/ffsepn_P7IvEpp6uBJQ4HQ)
综上,稳定细胞系平台不仅从源头提升了LVV的安全性、一致性与可扩展性,也为in vivo CAR-T疗法的临床转化和产业化落地提供了坚实的技术基础。未来,该方向的持续优化与创新将是推动in vivo CAR-T慢病毒递送路线商业化成功的关键。
谁将定义In Vivo CAR-T的工业标准?
In vivo CAR-T无疑是细胞治疗领域最激动人心的前沿方向之一,它承载着将“天价”疗法平民化的希望。在这场通往未来的竞赛中,递送载体的选择是决定技术路线成败的第一个关键分岔口。LNP以其灵活性和在其他领域的成功吸引了大量关注,慢病毒载体凭借其无可比拟的持久表达潜力,似乎更贴近CAR-T疗法追求长期控制乃至治愈的初衷。
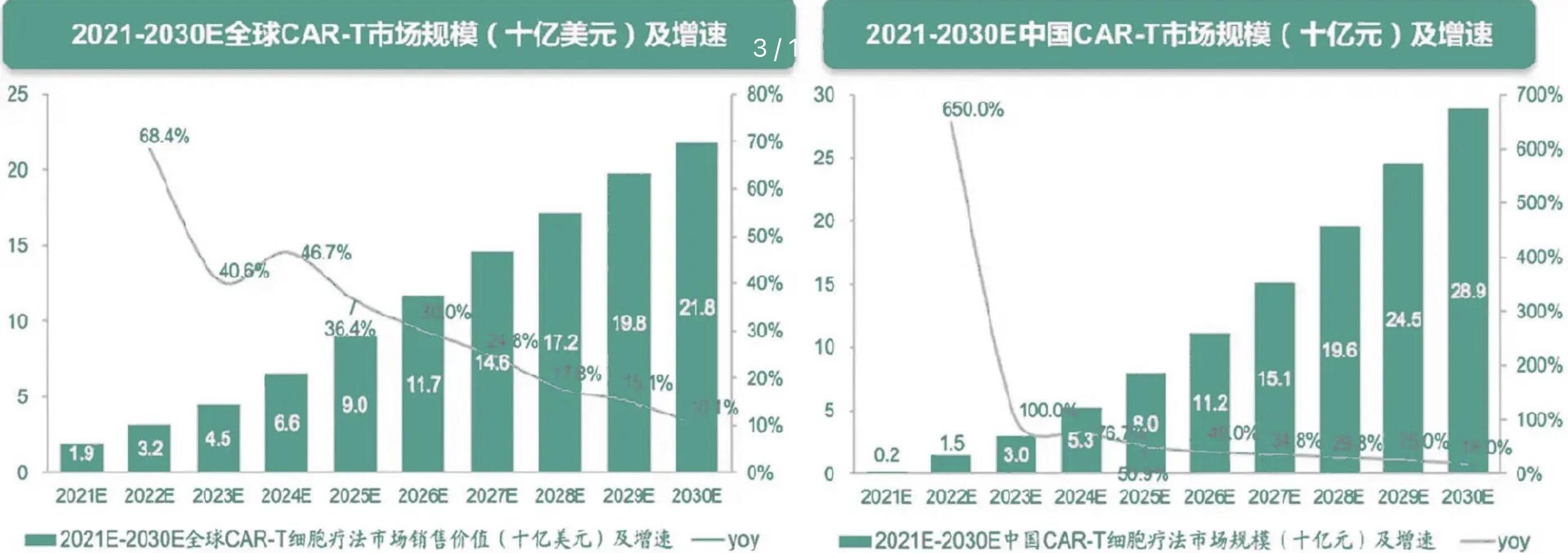
(图源:松禾资本)
当EsoBiotec、Umoja等先行者已将in vivo CAR-T疗法推向临床,初步验证了其可行性时 ,一个更为严峻的工业化问题也随之浮出水面:当前实验室中大量使用的精细工艺,能否支撑起未来巨大的市场需求?这一“实验室”的生产模式,其固有的高成本与批次间的不稳定性,正成为悬在这些创新疗法商业化道路上方的“达摩克利斯之剑”。
因此,行业的未来将不可避免地从“疗效”转向“制造”。这些走在最前沿的公司,将如何跨越从临床样品制备到大规模商业化生产的鸿沟?最终,能够定义行业标准的,或许正是那些率先破解了这一制造难题,协助创新疗法稳稳放入“货架”的企业。











.jpg)





